在生命科学研究领域,如何将成体细胞高效逆转为多能干细胞(iPSCs)长期以来是一项颇具挑战性的课题。传统技术主要依赖一组特定的重编程因子,这些因子能够诱导成体细胞回归到类似胚胎的未分化状态,从而为再生医学开辟了新的可能性,如再生组织和治愈无法治疗的疾病。近期,OpenAI与Retro Biosciences的最新合作令人振奋,它们成功地应用深度学习技术,创新地设计出经过优化的蛋白质变体,为干细胞研究提供了新的思路和工具。
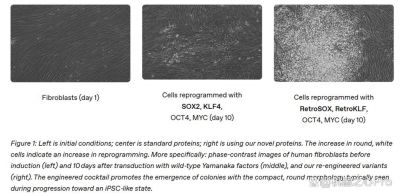
研究团队的核心成果是开发了一个名为GPT-4b micro的定制模型。其设计初衷是为了增强蛋白质序列的设计能力,并解决传统蛋白质重编程方法效率低下的问题。回顾过去,科学界曾普遍认为细胞一旦分化就无法逆转,但日本科学家山中伸弥通过引入特定基因,一举改变了这一看法,开创了iPSCs的研究。凭借这一重大发现,两位科学家于2012年荣获诺贝尔生理学或医学奖。
尽管山中伸弥的发现为蛋白质重编程提供了基础,但效率依然是一个瓶颈,通常只有不到0.1%的细胞能成功转化为iPSCs,而这一过程耗时长达数周。OpenAI的研究通过GPT-4b micro的助力,使得科学家们能够设计出具有更高效率的蛋白质变体,这解决了许多传统方法所无法克服的问题。该模型不仅超越了现有蛋白质设计工具,还在对成体细胞的重编程过程中展现出与以往方法相比更显著的优势。
在实际操作中,OpenAI与Retro Biosciences团队结合使用了多种递送方法和细胞类型,不同于以往使用病毒载体的方式,采用了mRNA作为递送工具的尝试,为细胞组合提供了更灵活和安全的选择。这种新型的递送方式使得重编程成功率显著提升,研究人员发现,通过与膝关节源自50岁以上老年症者的间充质干细胞相结合,超过30%的细胞能够在七天内开始表达关键多能性标记物。
OpenAI的研究还重点关注了蛋白质重编程后的细胞年轻化潜力,探索经过重编程的细胞能否恢复特定功能,比如修复损伤DNA的能力。研究显示,与标准的蛋白质重编程方案相比,OpenAI开发的新型变体在清除细胞内与DNA损伤相关的衰老标记方面表现出更加强大的能力。这意味着,未来的研究不仅可以推动干细胞转化的进程,还能为抗衰老疗法的开发带来新的视角。
值得一提的是,OpenAI的研究不仅仅是对新型蛋白质的开发,还为科学研究引入了一种颠覆性的创新模式。通过将深度学习与生命科学相结合,研究者们可以在几天内解决原本可能需要数年才能克服的问题。这种进步不仅对当前的干细胞研究领域产生了深远影响,还为众多生物医学领域的发展创造了无限可能。
OpenAI与Retro Biosciences的合作标志着一种崭新的科研范式的到来,未来的科学研究将从数据驱动的发掘中获取更多启示。随着科学技术的不断演进,如何高效利用那些复杂的生物数据,将是推动科研进步的关键。在不久的将来,随着这些创新技术的普及,人类在干细胞研究和再生医学领域将迎来更多的突破,帮助改善人类健康,延缓衰老,并解决诸如器官短缺等迫在眉睫的临床挑战。
此项研究的成功不仅展示了新型蛋白质的高效性能,也为未来的药物设计、新疗法创制和其它生物科学的探索带来新的可能性。通过跨学科的合作,OpenAI与Retro Biosciences正在共同开创一个充满希望的科研新纪元。
